磷酸盐分析滴定方法「磷酸盐的滴定曲线」
各位访客大家好!今天小编关注到一个比较有意思的话题,就是关于磷酸盐分析滴定方法的问题,于是小编就整理了几个相关介绍的解答,让我们一起看看吧,希望对你有帮助
盐酸滴定磷酸盐混合溶液分析
1、解:此问题属于酸碱中和滴定中的混合指示剂测混合盐。三种盐不能同时存在。要么是磷酸钠、磷酸氢二钠组合。要么是磷酸氢二钠、磷酸二氢钠组合。(磷酸钠与磷酸二氢钠会变成磷酸氢二钠,不会存在)。
2、在实验中,第一个可观察到的终点是滴定到H2PO4-。这时溶液的pH~5,可用甲基红指示剂。所消耗的标准液NaOH的量对应于溶液中盐酸的量 (X mol)+磷酸量(Y mol)。再用一个平行试样,滴定至HPO42-。
3、,混合酸的测定 移液管取200ml混酸+甲基橙(1滴)+NaoH滴定(红——黄),此时体积为V1+酚酞(1滴)+NaoH滴定(黄——橙),此时体积为V2。
4、在盐酸和磷酸混合酸溶液中,Ce4+和Fe2+的反应同样是发生的,但是磷酸可以起到缓冲作用,稳定溶液的pH值,从而使滴定曲线更加平缓。
请问一个关于盐酸两步滴定混合磷酸盐的问题:
1、双指示剂法测定磷酸盐的原理准确称取一定量试样,溶解后以酚酞为指示剂,用盐酸标准溶液作滴定剂滴定到指示剂变色(由红色至红色刚好消失),即为到达第一滴定终点。
2、加入盐酸:CaHPO+2HCl=CaCl+HPO(沉淀溶解)【如果盐酸不足量,也会产生磷酸二氢钙和氯化钙部分溶解。2CaHPO+2HCl=CaCl+Ca(HPO)】。
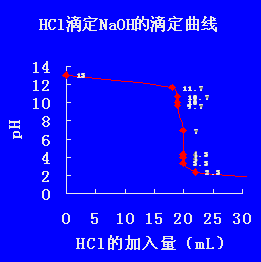
3、用标准氢氧化钠溶液滴定等浓度的盐酸与磷酸的混合溶液,在滴定曲线上应该出现四个突跃范围。第一个突跃范围是盐酸反应完毕,开始中和磷酸的第一个氢。第二个突跃范围是磷酸的第一个氢中和完毕,开始中和第二个氢。
4、可以。沉淀法在这个情况下似乎并不合适,磷酸氢根盐和磷酸盐一样溶解度较小,难以找到单一沉淀的试剂,建议还是热分析。也可以用盐酸滴定。取样称量,溶解,加沉淀剂使磷酸根沉淀完全,烘干后称量沉淀。解一个二元一次方程。
5、甲液:取磷酸16ml,加水至1000ml,摇匀。乙液:取磷酸氢二钠763g,加水使溶解成1000ml。取上述甲液75ml与乙液25ml混合,摇匀,即得。
用酸碱滴定法测定盐酸和磷酸的混合液,具体怎么做
溶液显红色;在碱性溶液里,ph=7~8上述电离平衡向右移动,蓝色的离子是存在的主要形式,溶液显蓝色;在中性溶液里,ph=7红色的分子和蓝色的酸根离子同时存在,所以溶液显紫色。
HCl+NaOH=NaCl+H H3PO4+2NaOH=Na2HPO4 我们先主要看弱酸磷酸,磷酸pka1为12 Pka2为21 pka3为166 三部电离的pka差值大于四,说明可以分步滴定。
酸碱滴定法:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。可用于测定酸、碱和两性物质。其基本反应为H﹢+OH﹣=H2O也称中和法,是一种利用酸碱反应进行容量分析的方法。
滴定液只需要用氢氧化钠。先用甲基橙作指示剂。滴定到终点橙色时,盐酸消耗完,磷酸全成为磷酸二氢钠。消耗氢氧化钠V1。后用酚酞作指示剂。滴定终点红色时,溶液中全是磷酸钠。消耗氢氧化钠V2。n磷酸=2n氢氧化钠V2。
硝酸,分别加入一个小铜片,产生气泡(NO或NO2),且溶液变蓝(硝酸铜)的是硝酸。无现象的是磷酸和盐酸。再取2只试管,加入盐酸,磷酸,向其中加入过量的氢氧化钡溶液,出现沉淀的是磷酸(磷酸三钡),无现象的是盐酸。
小伙伴们,上文介绍磷酸盐分析滴定方法的内容,你了解清楚吗?希望对你有所帮助,任何问题可以给我留言,让我们下期再见吧。