磷酸盐标准缓冲液的ph值_磷酸盐缓冲液ph80
嗨,朋友们好!今天给各位分享的是关于磷酸盐标准缓冲液的ph值的详细解答内容,本文将提供全面的知识点,希望能够帮到你!
药物分析——药品pH值测定法
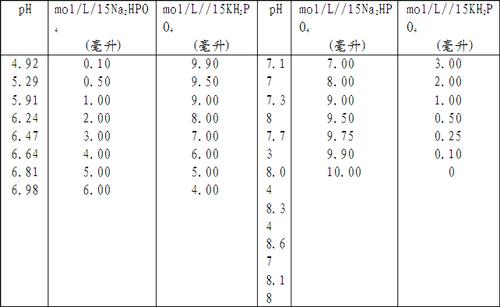
水溶液的ph值应以玻璃电极为指示电极,用酸度计进行测定。酸度计应定期检定,使精密度和准确度符合要求。仪器校准(定位)用的标准缓冲液应使用标准缓冲物质配制,配制方法如下。
酸碱滴定法:酸碱滴定法在药品分析检测中的应用十分广泛,是将一种已知其准确浓度的试剂溶液滴加到被测物质的溶液中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积可以求得被测组分的含量。
热重分析法:热重分析法(TGA)是在程序控制温度下,测量物质质量与温度关系的方法。特点是能准确测量物质质量变化及发生变化的温度,样品用量少,比通常干燥失重法测定速度快。
酸碱指示剂法:将酸碱指示剂加入待测溶液中,根据溶液的颜色变化判断其 pH 值。例如:苯酚红指示剂适用于 pH 值在 8~4 范围内的测定。
pbs缓冲液ph范围
1、它的pH缓冲范围一般在pH8-8之间,适用于分子克隆和细胞培养等实验。Tris缓冲液不仅被广泛用作核酸和蛋白质的溶剂,还有许多重要用途。
2、PBS为磷酸盐缓冲液,有效PH在4左右。PH为3的PBS没有意义,配不出来或者勉强用盐酸调到此PH也没有缓冲力,而PH为0的可以配。
3、PBS缓冲液PH值在2-4之间,是细胞最适合的PH值范围。且在酸碱微量的刺激下PH值基本不会发生变化。
4、PBS缓冲液(pH2~4):NaCl 137mmol/L,KCl 7mmol/L,Na2HPO4 10mmol/L,KH2PO4 2mmol/L PBS缓冲液一般作为溶剂,起溶解保护试剂的作用,具体试剂一般也有不同的比例配方,在针对性上就有了更好的效果。
5、最终 测定PBS液的PH值约为4。磷酸盐缓冲液 取磷酸二氢钠30g,与磷酸氢二钠04g,加水使成1000ml,即得。磷酸盐缓冲液(pH0) 甲液:取磷酸16ml,加水至1000ml,摇匀。
磷酸缓冲溶液pH值的计算
1、得到NaH2PO4;pH=1/2(pKa1+pKa2)。
2、缓冲溶液的pH值计算方法是根据Henderson-Hasselbalch方程式得出的。该方程式表示了弱酸与其盐溶液之间的平衡常数与溶液pH值的关系。确定缓冲溶液中的弱酸和其共轭碱的浓度。
3、磷酸盐缓冲液(含胰酶)(pH8)取磷酸二氢钾8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。
4、磷酸二氢钠是标准缓冲溶液,用计算缓冲溶液PH的公式计算即可。
0.05mol/L磷酸盐缓冲液(pH7.0)如何配制?
1、首先单独配制0.05mol/L的NaH2PO4溶液和0.05mol/L Na2HPO4的溶液 之后取65mlNaH2PO4溶液与35mlNa2HPO4溶液,混合,即可。
2、《矿石及有色金属分析手册》中的pH标准液,2,取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液12ml,用水稀释至100ml,即得。
3、要配制0.025mol/L磷酸盐缓冲液pH4,首先需要知道所用的磷酸盐的酸解离常数(pKa值)。假设所用的是二氢磷酸盐(H2PO4^-)和磷酸根离子(HPO4^2-)组成的缓冲体系,其pKa值约为2。
4、查化学手册查出磷酸二氢根的电离常数(也就是磷酸的二级电离常数)ka,求出pka,然后根据公式可以算出磷酸二氢钾与磷酸氢二钾的浓度比[a]/[b]。然后按照这个比例配制0.05mol/l磷酸钾缓冲液。
5、磷酸盐缓冲液配制方法如下:称取8gNaCl、0.2gKCl、44gNa2HPO4和0.24gKH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至4,zui后加蒸馏水定容至1L即可。
6、或者是39克磷酸氢二钠(带12个结晶水)溶解于水中,定容道1升的容量瓶中。取A1溶液390毫升,A2溶液610毫升混合均匀即可。
pH值缓冲范围是
电离平衡常数的负对数加减1之间。即pK±1之间。例如以醋酸/醋酸盐为共轭酸碱对的缓冲溶液的有效缓冲范围是:PKa±1=75±1之间。即75-75之间。
范围在pH=pKa大于小于1之内。据查询缓冲液ph值与温度对照表得知:缓冲溶液的缓冲范围在pH=pKa大于小于1之内。缓冲溶液是一种能使PH值保持稳定的溶液。
缓冲溶液的有效缓冲范围为的PH值=PKa±例如以硫酸二氢盐/硫酸氢二盐为共轭酸碱对的缓冲溶液的缓冲范围为PH=PKa2±1=2±1,即P为2-2之间。
标准缓冲溶液pH=18,硼酸钠×10 H2O(硼砂)(pH18, Fisher Scientific或者NIST-SRM 187c)或其等效物。
氨—氯化铵缓仲液 pH0:取氯化铵 07g,加水使溶解成100ml,再加稀氨溶液1→30调节pH值至0,即得。
根据缓冲溶液的有效缓冲范围pH值约为pKa±1的原则,用六次甲基四胺配制的缓冲溶液的缓冲范围是pH:15至15。乌洛托品也称作六亚甲基四胺、六次甲基四胺,是一个与金刚烷结构类似的多环杂环化合物,分子式为C6H12N4。
小伙伴们,上文介绍磷酸盐标准缓冲液的ph值的内容,你了解清楚吗?希望对你有所帮助,任何问题可以给我留言,让我们下期再见吧。