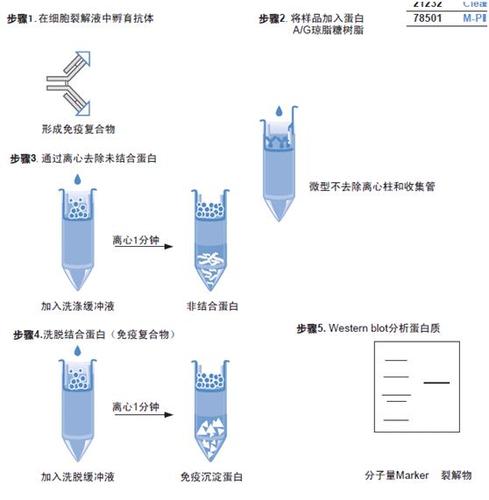
纯化蛋白用tris还是磷酸盐
嗨,朋友们好!今天给各位分享的是关于纯化蛋白用tris还是磷酸盐的详细解答内容,本文将提供全面的知识点,希望能够帮到你!
蛋白纯化阴离子交换,缓冲液带什么电荷
既然是阴离子交换,就要让目标蛋白带负电,那么缓冲液PH就要大于等电点。缓冲体系的选择也很重要,一般用TRIS-HCl,特别是弱阴离子柱不可选用带负电强的磷酸盐缓冲液,否则上样液中被交换的将是磷酸根而不是目标蛋白。
阴离子交换剂在pH0时,带有稳定的正电荷,可与蛋白质的阴离子结合。当被分离的蛋白质溶液流经离子交换剂柱时,带有相反电荷的蛋白质可因离子交换而吸附于柱上,随后又可被带同样性质电荷的离子所置换而被洗脱。
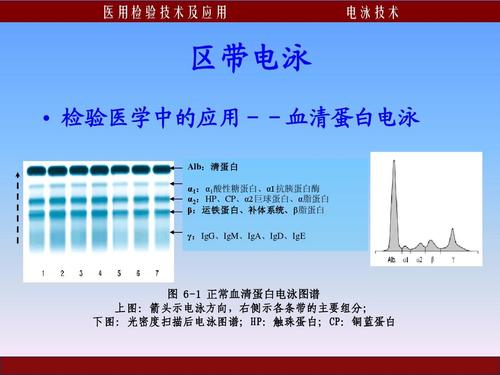
【答案】:C血清蛋白的等电点PI均≤7.3,在pH8.6缓冲液中,pHPI时,血清蛋白上的羧基电离出H与碱性溶液中OH结合,血清蛋白均带负电荷。
带正电荷。蛋白质在溶液中有两性电离现象。假设某一溶液中含有一种蛋白质。当pI(等电点)=pH时该蛋白质极性基团解离的正负离子数相等,净电荷为0,此时的该溶液的是pH值是该蛋白质的pI值。
蛋白质的电荷可以是正电荷、负电荷或零电荷,取决于其中氨基酸残基的离子化状态和环境pH值等因素。氨基酸的电离 酸性氨基酸:酸性氨基酸如天冬氨酸和谷氨酸在中性条件下会失去一个质子形成相应的阴离子,带负电荷。
离子交换层析法:利用不同的蛋白质在缓冲溶液中所带电荷不同,与某一载体上的具有相反电荷的离子基团进行吸附,然后进行解脱,达到纯化蛋白质目的。常用载体:纤维素DEAE,带正电,吸附带负电的Alb、α、β球蛋白。
TRIS试剂是什么?
tris是三羟甲基氨基甲烷。Tris(三羟甲基氨基甲烷)是生化实验中最常使用的缓冲液,因为它有好的缓冲能力、毒性低、对生物反应的干扰极低,而且纯度很高。
tris是三羟甲基氨基甲烷,可作为生物缓冲剂,用于凝胶电泳配置缓冲液。三羟甲基氨基甲烷是一种有机物,化学式为C4H11NO3,白色结晶颗粒。可作为生物缓冲剂;用于凝胶电泳配置缓冲液。
三羟甲基氨基甲烷(Tris)是一种常用的生物化学试剂,它在许多实验室和研究领域中被广泛应用。Tris具有多种特性和功能,使其成为许多实验和研究项目中不可或缺的一部分。首先,Tris是一种缓冲剂。
TE即Tris-EDTA buffer(10mM Tris,1mM EDTA,pH4 pH6 pH0)。常用分子生物学试剂,用于DNA的溶解等。
Tris是一种氨基醇类化合物,具有三个羟基和一个氨基基团。在SDS-PAGE中,Tris的主要作用是调节pH值,以维持电泳过程中溶液的酸碱平衡。此外,Tris还可以作为非离子去污剂和蛋白质沉淀剂等。
纯化蛋白质的方法
常见的蛋白分离纯化方法:盐析法、盐析法、离子交换层析法、亲和层析法、凝胶电泳法、高效液相色谱法。盐析法:利用不同蛋白质对盐浓度的敏感性差异,通过逐渐加入盐类使蛋白质沉淀析出,再通过离心去除沉淀物。
【答案】:蛋白质分离纯化的主要方法:①盐析 根据性质:蛋白质的沉淀。作用机制:中性盐中和表面电荷,破坏水化层。影响因素:表面电荷、水化层、溶剂性质。②电泳 根据性质:蛋白质的两性解离。
由于某些特殊的目的,需要用聚丙烯酰胺凝胶电泳纯化蛋白质,常用下述方法进行:①从电泳后的凝胶上切下所需的相应条带,将凝胶压碎,用缓冲液浸泡,使其中的蛋白质扩散出来,从而获得纯化的蛋白质。此法简单但回收率低。
蛋白质分离纯化常用方法有:沉淀,电泳:蛋白质在高于或低于其等电点的溶液中是带电的,在电场中能向电场的正极或负极移动。根据支撑物不同,有薄膜电泳、凝胶电泳等。
常用的蛋白质纯化方法有离子交换色谱、亲和色谱、电泳、疏水色谱等等 离子交换色谱:蛋白质和氨基酸一样会两性解离,所带电荷决定于溶液pH。pH小于pI时蛋白质带正电,pH大于pI时蛋白质带负电。
蛋白质分离纯化常用的方法?
1、透析与超滤:透析法是利用半透膜将分子大小不同的蛋白质分开。超滤法是利用高压力或离心力,强使水和其他小的溶质分子通过半透膜,而蛋白质留在膜上,可选择不同孔径的泸膜截留不同分子量的蛋白质。
2、蛋白质分离纯化常用方法有:沉淀,电泳:蛋白质在高于或低于其等电点的溶液中是带电的,在电场中能向电场的正极或负极移动。根据支撑物不同,有薄膜电泳、凝胶电泳等。
3、【答案】:蛋白质分离纯化的主要方法:①盐析 根据性质:蛋白质的沉淀。作用机制:中性盐中和表面电荷,破坏水化层。影响因素:表面电荷、水化层、溶剂性质。②电泳 根据性质:蛋白质的两性解离。
4、常用的蛋白质纯化方法有离子交换色谱、亲和色谱、电泳、疏水色谱等等 离子交换色谱:蛋白质和氨基酸一样会两性解离,所带电荷决定于溶液ph。ph小于pi时蛋白质带正电,ph大于pi时蛋白质带负电。
纯蛋白为什么用磷酸盐洗脱
在做磷酸化蛋白的wb时是不能使用pbst的,原因很简单,pbst中也有磷酸基团。两种洗液我都用,用起来没有什么区别,都是提供一个缓冲的ph值环境,加上吐温20有助于蛋白的洗脱。
有机溶剂能降低蛋白质溶解度的原因有二:其与盐溶液一样具有脱水作用;其有机溶剂的介电常数比水小,导致溶剂的极性减小。
防止蛋白质变性:蛋白质在某些条件下会发生变性,如高温、强酸、强碱等。在分离和提纯蛋白质的过程中,应避免使用这些条件,以保持蛋白质的生物活性。
,容易配制,经济方便;2,受温度影响小,缓冲能力强;3,对大部分蛋白和酶的结构及活性没影响,便于后续实验。需要指出的是,不是所有的酶都适用于磷酸缓冲液,如某些以磷酸根为底物的酶。
球蛋白具有免疫作用。在简述分子当中,筛凝胶储层析法提纯血清球蛋白是具有免疫作用,所以是要用洗脱液的。洗脱液是一种交换树脂后所得到的溶液,产生方式为再生液流过已饱和的离子。
能使蛋白质沉淀的试剂
1、A.B.C都可以,起初是促进溶解,但是随着盐浓度的上升,上述三者都可以让蛋白析出为沉淀。
2、盐析是将硫酸铵、硫酸钠或氯化钠等加入蛋白质溶液,使蛋白质表面电荷被中和且水化膜被破 坏,导致蛋白质在水溶液中的稳定性因素去除而沉淀。
3、能使蛋白质沉淀的试剂书:浓盐酸和浓氢氧化钠溶液会使蛋白质变性。蛋白质的沉淀剂有 加热,大部分蛋白质在温度超过60摄氏度以上会变性,沉淀。盐析法沉淀:硫酸铵分级盐析法,蛋白质疏水集团暴露,沉淀。
以上内容就是解答有关纯化蛋白用tris还是磷酸盐的详细内容了,我相信这篇文章可以为您解决一些疑惑,有任何问题欢迎留言反馈,谢谢阅读。